中間試験の講評

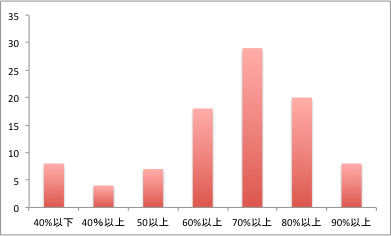
12月26日に行った中間試験の平均点は69点でした。成績分布は上のグラフのようになりました。多数の諸君がよくできていました。直前に配ったプリントを元に復習を進めてくれた結果だと思います。点数的にはよいのですが、問題別にみたときにはいくつか気づきがありますので、期末試験に向けては下記を参考にもっと勉強を進めて下さい。
1.覚えなさい、といっておいた芳香族の共鳴安定化エネルギーやブタンのコンホメーションのエネルギー変化はほとんどの諸君が書けていました。ただ、これは基礎にすぎないので、この数値をベースにしてコンホメーションや共鳴安定化についてしっかり理解を深めて下さい。
2.共鳴構造式を書かせる問題では、形式電荷や電子数があやふやな答案が多く見られました。常に最外殻電子の数がどうなるのかを考えて、共鳴構造式を書きましょう。共鳴構造式の寄与の大きさは、電荷が分離していないか、オクテットを満たしているのか(最外殻電子数が8なのか6なのか)、電荷分離した場合電気陰性度の大きな原子に「負電荷」が来るかどうか、の3点が判断基準となります。たとえ電荷分離がなかったとしても、最外殻電子数が6であれば、その構造式の寄与は最外殻電子数が8のものより小さくなります。
3.酸性度の強弱について、答案を見ている限りよくわかっていない印象を受けました。酸として強くなるためには、共役塩基(H+がとれたアニオン)の安定化が重要となります。その際、生じたローンペアが共役を通じて共鳴構造をたくさん持てば安定化が図られ、共役塩基が発生させやすくなる(=プロトンをたくさん出す)ことになって酸として強くなります。したがって、答案には、例えば下記のような「意味のわかる文章」を書いていただかなければ、諸君の答案の意図が理解できません。例えば
「プロトンが解離したあとの共役塩基の炭素(あるいは酸素など)上に生じたローンペア電子対が、ベンゼン環(あるいはカルボニル基など)と共役できるので、共鳴構造を持ち・・・・」と
こういった「主語」や「目的語」が明確化(具体化)された文章で文章で説明する必要があります。大多数の諸君の答案は、主語や目的語が書かれていなかったり不明瞭であったりするので、答案の文章では何を主張しようとしているのかまったく意味不明なものが多くありました。これらは採点側が内容を理解できないので0点にしました。説明するための日本語(または英語)をちゃんと書けるようになっておきましょう。これも試験対策、ひいては社会に出るための勉強の一つですし、これから極めて重要になります。
期末試験は2月に行われますが(詳細は共通教育の予定をみて確認しておくこと)、試験は全範囲になりますので今からしっかり勉強して準備しておいて下さい。少なくとも上記の3で指摘したように、何を言いたいのかわからない文章の答案には、意味がわからないので正解としては扱えませんから、留意しておくこと(これは化学Ⅱに限りません)。
なお、中間試験を受けていない数名の諸君については、予告通り不可です。次年度以降にがんばってください。
Monday, 7 January 2019